Nobelov komitet pri Karolinska institutu u Stokholmu ove 2024. godine doneo je odluku da Nobelovu nagradu za fiziologiju ili medicinu uruči dvojici američkih naučnika, Viktoru Ambrosu i Gariju Ruvkunu za otkriće mikro ribonukleinske kiseline (engl. Micro Ribonucleotide Acid, miRNK) i opis njene uloge u posttranskripcijskoj regulaciji ekspresije gena. Ovim tekstom želimo da odamo priznanje ovoj dvojici naučnika i da vidimo kakve sve mogućnosti ovo otkriće otvara na polju neuronauka

Ljudsko telo sačinjeno je od 10 biliona ćelija. Sve te ćelije imaju iste gene zapisane u sklopu dezoksiribonukleinske kiseline (DNK). Ako sve ćelije imaju iste gene kako je onda moguće da se one razlikuju međusobno što vodi postojanju više različitih tkiva i organa? Ova pojava rezultat je procesa koji nazivamo genska ekspresija. Znamo da se geni mehanizmima transkripcije prepisuju u informacione ribonukleinske kiseline (iRNK), a onda procesom translacije prevode u proteine. Ekspresija gena bi značila kontrola da li će se neki gen prepisati u ribonukleinsku kiselinu ili ne. Ako se prepiše u iRNK sledeći korak je njeno prevođenje u protein. Međutim, znamo da se svega 10% gena u našoj DNK prevodi u proteine, šta je sa preostalih 90%?
Od otkrića DNK pa do danas ispituju se procesi ekspresije gena. Tako je otkriveno da u sklopu DNK postoje geni koji se samo prepisuju u RNK molekule ali se posle oni ne prevode u proteine već obavljaju druge uloge. Te RNK nazivamo nekodirajuće RNK. One se dele na dve grupe. Prva grupa su duge nekodirajuće RNK koje su sačinjene od više stotina nukleotida. To su ribozomalna RNK (rRNK) koja gradi ribozom, organelu u kojoj se proteini sintetišu i transportna RNK (tRNK) koja transportuje amino kisleine neophodne za sintezu proteina. Druga grupa nekodirajućih RNK su male RNK, one su sačinjene od desetina nukleotida i ovu grupu upravo spadaju miRNK.
Ambros i Ruvkin su 80-ih godina prošlog veka ispitivali ekspresiju gena na jednoj vrsti valjkastih crva nazvanoj Caenorhabditis elegans. Oni su otkrili da ova vrsta poseduje gene koji se prepisuju u jako male nekodirajuće RNK, sačinjene od svega 20-ak nukleotida, a koje se onda vezuju za iRNK i sprečavaju da se ona prevede u protein. Ovo znači da ćelije eksprimiraju ove male RNK koje onda selektivno sprečavaju da se neki proteini u ćelijama sintetišu, vodeći tome da se ćelije međusobno razlikuju, odnosno igraju ključnu ulogu u ćeliskoj diferencijaciji. Te male RNK nazvali su mikro RNK i svoje otkriće objavili 1993. godine, ali tek 10-ak godina kasnije kada je otkriveno da miRNK postoje i kod sisara, pa i čoveka, njihovo otkriće dobija na značaju. Danas ovaj proces sprečavanja iRNK da se prevede u protein nazivamo utišavanje gena (engl. gene silencing).

Zašto je ovo važno? Činjenica da znamo za postojanje molekula koji učestvuju u kontroli ekspresije gena nam omogućava da bolje razumemo proces ćelijske diferencijacije, potom da razumemo nastanak nekih bolesti koje su posledica mutacije na genima za miRNK (već su otkrivene mutacije na genima za različite miRNK koje se dovode u vezu sa nastankom karcinoma), i na kraju da miRNK koristimo kao markere bolesti i mete prema kojima ćemo usmeriti terapiju. Važno je naglasiti da je od te 1993. do danas otkriveno na više hiljada različitih podtipova miRNK koje selektivno kontrolišu ekspresiju jednog ili manjeg broja gena, te se izraz miRNK odnosi na minimum 2000 do sada poznatih tipova ovog molekula.
Neuronaučnike zainteresovala je moguća implikacija miRNK na fiziologiju i patologiju nervnog sistema što je rezultiralo različitim studijama koje su ispitivale miRNK. Najveći broj istraživanja ispitivao je uloge miRNK u neurodegenerativnim bolestim i multiploj sklerozi, te će se ovaj tekst ograničiti na ove dve grupe bolesti.
Neodgovarajuća ekspresija gena za miRNK uzrokuje različite patološke procese unutar CNS-a. Kada kažemo neodgovarajuća ekspresija znači da se neki tipovi preterano sintetišu i preterano su aktivni, dok se drugi tipovi smanjeno sintetišu i manje su aktivni. Ovo je slučaj i u neurodegenerativnim bolestima. Naime, ispitujuću eksperimentalne modele Alchajmerove bolesti otkriveno je da miRNK, kao što su miR-135, miR-155 ili miR-206, koje se preterano sintetišu, pojačavaju proinflamatornu aktivnost mikroglije, smanjuju protektivnu aktivnost astrocita, suprimišu sinaptogenezu, remete ekspresiju enzima odgovornih za obradu amiloda β i tau proteina, osnovnih patoloških supstrata Alchajmerove bolseti.
Sa druge strane, određeni tipovi miRNK, kao što su miR-22 i miR-146a, se smanjeno sintetišu a znamo da značajno smanjuju proinflamatornu aktivnost mikroglije u Alchajmerovoj bolesti te postoji potencijal njihove primene kao terapije ove bolesti. Do sličnih zaključaka došlo se ispitujući ostale neurodegenerativne bolesti, kao što su Parkinsonova bolest i amiotrofična lateralna skleroza, te je zaključak da određeni tipovi miRNK svojom neodgovarajućom aktivnošću doprinose razvoju bolesti, dok drugi imaju protektivne efekte.
S obzirom da postoje određeni tipovi miRNK koji doprinose razvoju bolesti, da li ih mi možemo koristiti kao biomarkere? Naravno da da! Međutim, da bismo koristili neku supstancu kao biomarker prvo moramo da do nje dođemo. Najlakši pristup je uzimanje vanćelijskih tečnosti, kao što je krv, pljuvačka, urin ili cerebrospinalna tečnost i određivanje biomarkera u njima. Ispitivajuću vanćelijsku tečnost otkriveno je da se miRNK može naći u serumu i cerebrospinalnoj tečnosti u velikim količinama. U ovim tečnostima miRNK možemo određivati u sklopu određenih ćelija, npr. granulocita, limfocita i sl. ali miRNK se može naći i samostalno kao slobodno cirkulišuća ili grupisana sa proteinima i lipidima u strukturu koju zovemo egzon. To je mala struktura koja omogućava komunikaciju između ćelija, tako što jedna ćelija otpusti materije koje ulaze u sastav egzona, on zatim putuje putem vanćelijske tečnosti do druge ćelije koja ga preuzme i koriste njegove sastavne delove. Ispitivanje seruma obolelih od Alchajmerove bolesti dovelo je do otkrića povišenih vrednosti različitih tipova miRNK kako kod eksperimentalnih životinja tako i kod ljudi. Ovo otkriće navodi naučnike na razvoj novih mehanizama kojima će određivati nivoe miRNK kao markera za dijagnozu Alchajmerove bolesti.
Zanimljiva je implikacija egzona koji sadrže miRNK na patogenezu Alchajmerove bolesti. Primarno žarište neurodegeneracije kod ove bolesti je medijalni region temporalnog režnja odakle se ona širi ka ostalim regionima mozga. Jedan od mogućih mehanizama širenja je upravo uz pomoć egzona koji sadrže miRNK. Dakle, jedna patološki izmenjena ćelija eksprimira neadekvatan tip miRNK, zatim se ova miRNK sa egzonom otpusti i pošalje ka zdravoj ćeliji. Kada dospe u nju, ta miRNK uzrokuje započinjanje patološkog procesa i patološku transformaciju ćelije, i tako redom. Ovo otkriće navodi na razmišljanje o razvijanju novih terapijskih strategija u lečenju Alchajmerove bolesti, koje bi ciljano remetile aktivnost patoloških miRNK i tako usporile progresiju ove bolesti.
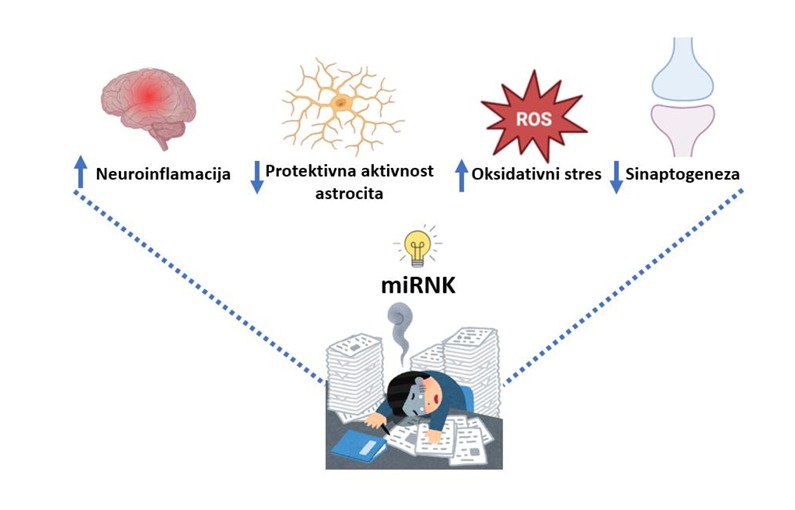
Drugo oboljenje gde je ispitivan uticaj miRNK je multipla skleroza. Od ovog hroničnog inflamatornog oboljenja oboljevaju osobe mlađe životne dobi, najčešće žene. Jedan od glavnih dijagnostičkih postupaka danas je postavljanje dijagnoze na osnovu kliničke slike, što ponekad dovodi do kasnog otkrivanja bolesti. Zato je važno otkrivati i ispitivati različite markere koji nam mogu pomoći u dijagnozi, razumevanju bolesti i novim načinima lečenja. Pokazano je da određeni tipovi miRNK, kao što su miR-155 i miR-326, pojačano aktivni u ćelijama imunskog sistema, pre svega Th17 ćelijama koje su, na osnovu dosadašnjih saznanja, centralni nosioci patogenetskih mehanizma u multiploj skelrozi. Sa druge strane tipovi miRNK kao što su miR-15b i miR-132 su smanjeno aktivni u ovim ćelijama. Ispitivane su i druge ćelije značajne za patogenezu multiple skleroze kao što su makrofagi, drugi tipovi limfociti itd. i došlo se do sličnih zaključka, povećane aktivnosti jednog tipa a smanjene aktivnosti drugog tipa miRNK. Izmenjena aktivnosti rezultira povećanom proinflamatotnom aktivnosti ćelija, povećanom lučenju proinflamatornih citokina i posledično značajnom porastu oksidativnog stresa. Ovo je osnova za bolje razumevanje patogeneze i moguću primenu ovih saznanja u lečenju multiple skleroze.
Slično kao i u neurodegenerativnim bolestima i u multiploj sklerozi, ispitivanjem krvi pacijenata otkriveno je da se određeni tipovi miRNK pojačano eksprimiraju i mogu biti dobar marker bolesti. Zanimljivo je istraživanje koje je ispitivalo ekspresiju miRNK u mononuklearnim ćelijama u perifernoj krvi, čiji autori su zaključili da se ekspresija miRNK razlikuje u zavisnosti od faze bolesti. U relapsnoj fazi bolesti uočena je disregulacija aktivnosti miR-18b i miR-599, dok je u fazi remisije pokazana disregulaija miR-96. Time nam se otvaraju vrata za nove dijagnostičke metode i raniju dijagnozu multiple skleroze, kao i jasno razlikovanje faza bolesti.
Kako možemo koristiti miRNK u terapiji? Recimo da znamo da preterana sinteza miRNK dovodi do nastanka bolesti. Cilj bi nam bio da smanjimo tu sintezu a to bismo postigli ciljanom terapijom (engl. target therapy). Takođe, kao što sam pomenuo u predhodnom tekstu, neki tipovi miRNK imaju protektivne efekte u određenim bolestima i neki autori navode moguću primenu upravo miRNK kao terapeutika koji će da poboljšaju sinaptogenezu, smanje neuroinflamaciju, doprinesu integritetu krvno – moždane barijere itd.
Cilj ovog teksta bio je da odamo priznanje naučnicima čije je delo napravilo veliki pomak u nauci i da kroz primer nervnog sistema vidimo rezultate njihovog rada na delu. MikroRNK je budućnost, a ona nam je sve bliža!
Autor:Mladen Mirković
Literatura:
- 1. Nobelova nagrada. Nobelova nagrada za fiziologiju ili medicinu 2024: Saopštenje za javnost (Internet). 2024 (pristupljeno 2024. okt 12). Dostupno na: https://www.nobelprize.org/prizes/medicine/2024/press-release/?utm_source=instagram&utm_medium=social+media+&utm_campaign=nobel+prize+announcements+2024&utm_content=post
- 2. Nobelova nagrada. Nobelova nagrada za fiziologiju ili medicinu 2024: Saopštenje za javnost (Internet). 2024 (pristupljeno 2024. okt 12). Dostupno na: https://www.nobelprize.org/prizes/medicine/2024/press-release/?utm_source=instagram&utm_medium=social+media+&utm_campaign=nobel+prize+announcements+2024&utm_content=post
- 3. Radivoje Papović i saradnici. (2016). Humana genetika : autorizovana skripta za studente I godine.Medicinski fakultet Beograd.
- 4. Nikolac Perkovic M, Videtic Paska A, Konjevod M, Kouter K, Svob Strac D, Nedic Erjavec G et al. Epigenetics of Alzheimer’s Disease. Biomolecules. 2021; 11(2):195
- 5. Yang R, Yang B, Liu W, Tan C, Chen H, Wang X. Emerging role of non-coding RNAs in neuroinflammation mediated by microglia and astrocytes. J Neuroinflammation. 2023; 20(1):173.
- 6. Zhai L, Shen H, Sheng Y, Guan Q. ADMSC Exo-MicroRNA-22 improve neurological function and neuroinflammation in mice with Alzheimer’s disease. J Cell Mol Med. 2021;25(15):7513-23.
- 7. Nakano M, Kubota K, Kobayashi E, Chikenji TS, Saito Y, Konari N et al. Bone marrow-derived mesenchymal stem cells improve cognitive impairment in an Alzheimer’s disease model by increasing the expression of microRNA-146a in hippocampus. Sci Rep. 2020;10(1):10772.
- 8. Kumar A, Su Y, Sharma M, Singh S, Kim S, Peavey JJ et al. MicroRNA expression in extracellular vesicles as a novel blood-based biomarker for Alzheimer’s disease. Alzheimers Dement. 2023;19(11):4952-66.
- 9. Su L, Li R, Zhang Z, Liu J, Du J, Wei H. Identification of altered exosomal microRNAs and mRNAs in Alzheimer’s disease. Ageing Res Rev. 2022;73:101497.
- 10. Pogue AI, Hill JM, Lukiw WJ. MicroRNA (miRNA): sequence and stability, viroid-like properties, and disease association in the CNS. Brain Res. 2014; 1584:73-9.
- 11. Yang X, Wu Y, Zhang B, Ni B. Noncoding RNAs in multiple sclerosis. Clin Epigenetics. 2018; 10(1):149.
- 12. Otaegui D, Baranzini SE, Armananzas R, Calvo B, Munoz-Culla M, Khankhanian P, Inza I, Lozano JA, Castillo-Trivino T, Asensio A, et al. Differential micro RNA expression in PBMC from multiple sclerosis patients. PLoS One. 2009;4:e6309.
- Reijerkerk A, Lopez-Ramirez MA, van Het Hof B, Drexhage JA, Kamphuis WW, Kooij G et al. MicroRNAs regulate human brain endothelial cell-barrier function in inflammation: implications for multiple sclerosis. J Neurosci. 2013;33(16):6857-63.

Postavi komentar